过敏性疾病在全球范围内影响着数以亿计的人口,尤其在工业化国家中,超过四分之一的人深受其扰。过敏性疾病已成为严重的公共健康问题。
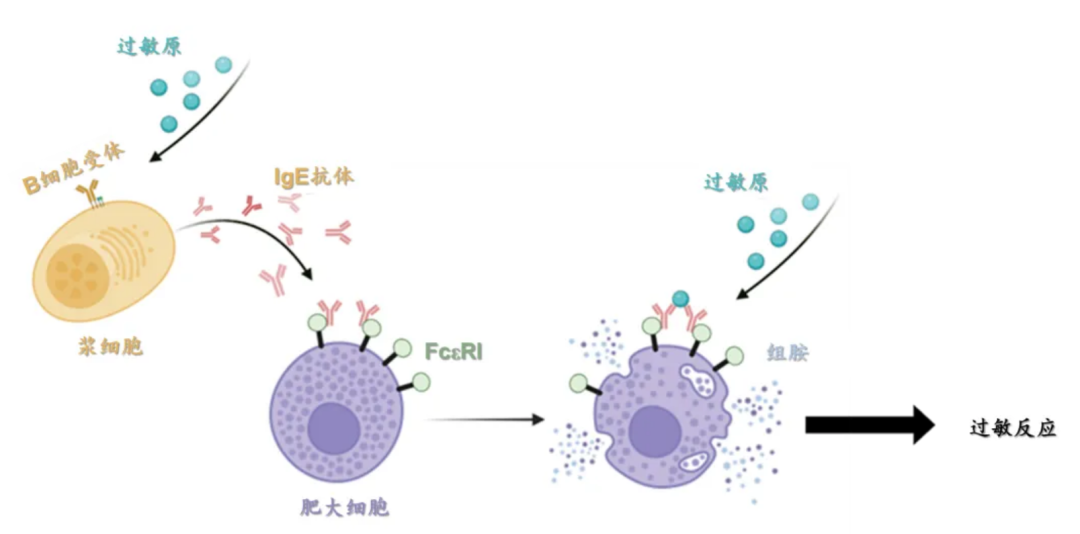
常见的过敏性疾病包括过敏性鼻炎、哮喘、特应性皮炎以及食物和药物过敏等。当免疫系统首次接触过敏原时,会产生一种被称为“免疫球蛋白E (IgE)”的抗体,此时,肥大细胞和嗜碱性粒细胞会通过高亲和力IgE受体(即FcεRI)参与免疫反应。当过敏原引发IgE抗体与FcεRI结合并交联时,肥大细胞和嗜碱性粒细胞会被激活,释放组胺等过敏介质,导致血管扩张、支气管收缩等过敏反应,严重时可引发全身过敏性休克(图1)。
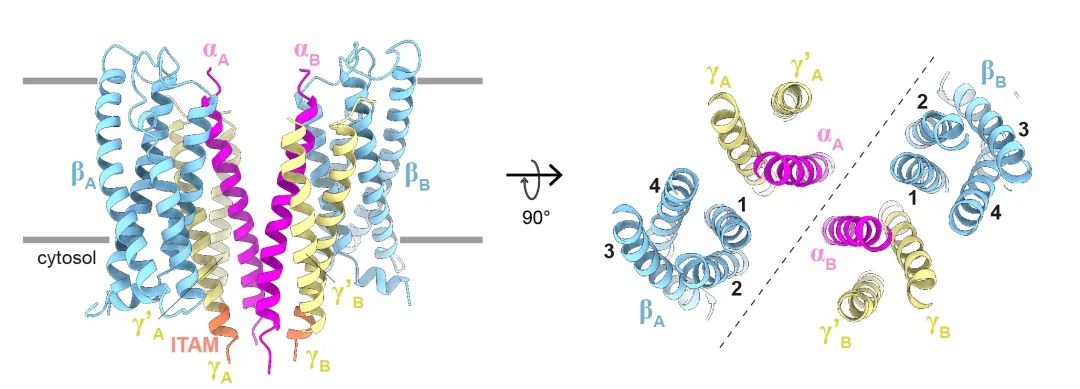
FcεRI是上世纪80年代初发现的多聚体细胞表面受体。它主要存在于人类的肥大细胞和嗜碱性粒细胞中,由一个α亚基、一个β亚基和两个γ亚基组成 (αβγ2) 。其中,α亚基包含两个免疫球蛋白样结构域,负责与IgE抗体的Fc区结合。β亚基和γ亚基分别具有四个和一个跨膜 (TM) 螺旋结构,每个亚基的羧基末端都带有一个免疫受体酪氨酸激活基序(ITAM)(图2)。当FcεRI与IgE抗体以及多价抗原结合时,ITAM基序会被Src家族的酪氨酸激酶LYN磷酸化,从而迅速启动信号级联反应,几分钟内释放炎症介质。

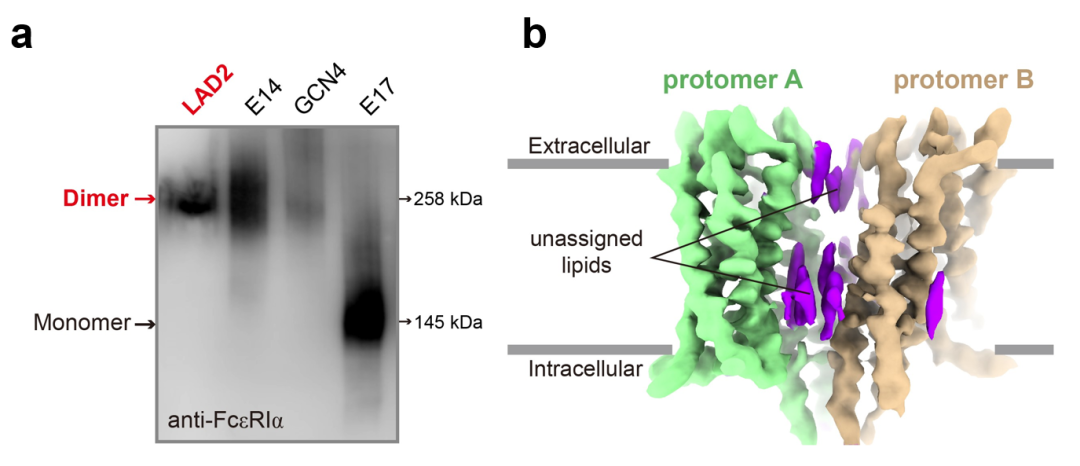
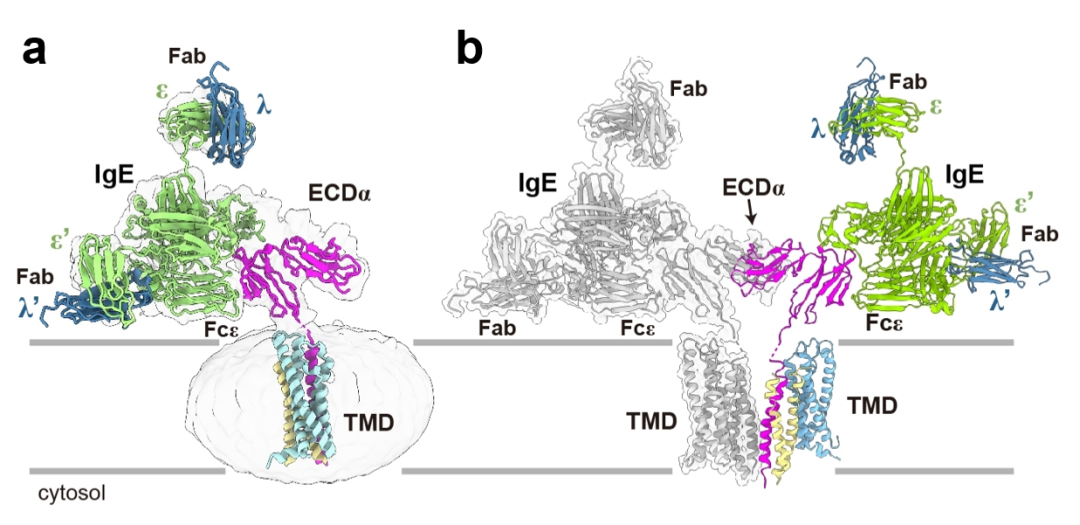
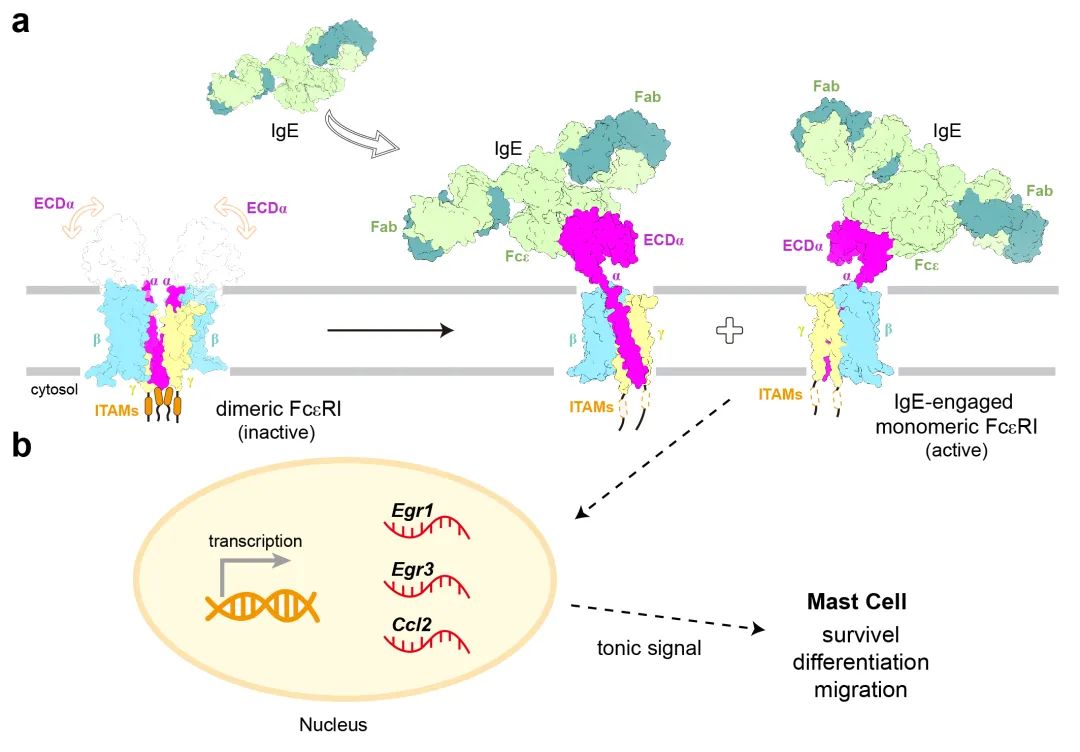
科学家们曾一度认为,IgE只是被动地附着在FcεRI受体上,不会直接影响肥大细胞的功能。然而,最近的研究表明,即便在没有抗原存在的情况下,IgE依然能通过与FcεRI结合,介导肥大细胞的一系列重要功能。例如,IgE可以调节肥大细胞的存活、分化和成熟。尤其值得注意的是,已有多种动物模型验证了这些IgE介导的效应,充分说明了IgE在过敏反应中的关键作用。因此,深入了解IgE介导的分子机制对于开发新的治疗方法具有重要意义。然而,由于缺乏FcεRI跨膜域的详细结构信息,IgE的作用机制仍未完全明了。2024年10月23日,深圳医学科学院特聘研究员宿强和西湖大学教授施一公在 Nature(《自然》)杂志在线发表了题为“Molecular mechanism of IgE-mediated FcεRI activation”(《IgE介导的FcεRI活化的分子机制》)的研究论文,首次揭示了这一关键免疫反应的分子机制。该研究填补了过敏反应中FcεRI受体活化机制的知识空白,并为开发治疗过敏性疾病的新策略提供了重要线索。研究团队首先聚焦于FcεRI受体。FcεRI受体在纯化过程中呈现出一种不均一的状态。初步的冷冻电镜分析显示,重组过表达的FcεRI受体同时存在二聚体 (α2β2γ4) 和单体 (αβγ2) 的状态(图3a, 3b),这一发现在超速离心实验中进一步得到证实(图3c)。图3. a.分子筛分析显示FcεRI呈现二聚体和单体两种形式。b. 分子筛处理后考马斯亮蓝染色的SDS-PAGE胶分析结果。c.分析型超速离心分析显示纯化的FcεRI以单体和二聚体两种形式存在。然而,这一发现与历史印象并不相同——经典免疫学教科书默认FcεRI受体呈现单体状态。由于实验样品采用的FcεRI受体来自异源细胞的过表达系统,有团队成员怀疑,他们发现的二聚体状态可能是过表达所导致的假象。敢于挑战权威是科学创新的关键。团队没有轻易认定二聚体是实验假象,而是创新性地使用蓝色非变性聚丙烯酰胺凝胶电泳技术,进一步研究人源肥大细胞系LAD2中FcεRI受体的寡聚化状态。在克服多项技术挑战之后,团队最终确认,内源性FcεRI受体的确主要以二聚体状态存在(图4a)!这一发现表明,过表达系统中的单体状态可能是一种不成熟的形式。图4. a.非变性聚丙烯酰胺凝胶显示FcεRI在人源肥大LAD2细胞系中主要以二聚体的形式存在。b.冷冻电子密度图显示FcεRI以二聚体形式存在。由此,可以确认,在生理状态下,肥大细胞中FcεRI受体主要以二聚体的形式。随后,研究团队开始着手解析FcεRI受体的结构。由于FcεRI受体非常小,且缺乏稳定的细胞外结构域,结构解析颇具挑战。经过近一年的冷冻电镜数据收集和处理,团队终于获得了3.7Å的近原子分辨率结构(图4b),证实FcεRI通过穿膜区的脂质和近膜区的螺旋结构形成二聚体(图5)。进一步的质谱分析和超速离心实验确认,穿膜区的胆固醇分子在稳定二聚体中发挥了重要作用。获得了FcεRI二聚体的组装机制,研究团队并未止步于此,而是将注意力转向了一个更为重要的免疫学问题:FcεRI受体是如何被IgE分子激活的?在实验中,当加入IgE抗体后,IgE抗体的Fc端如预期一样,与FcεRI受体的胞外区相结合。但令人意外的是,结合后的FcεRI受体竟然呈现出单体状态(图6a)!进一步分析表明,未结合IgE抗体时,FcεRI受体的胞外区随机摆动,高度动态。研究人员推测,当IgE抗体结合到FcεRI受体胞外区后,稳定了受体的结构,从而产生空间位阻,导致FcεRI受体从二聚体转变为单体(图6b)。这一推测通过团队设计的生物化学实验得到了验证。图6. a. IgE结合的FcεRI结构呈现单体形式。b. 一旦IgE结合到FcεRI的胞外区,两个ECDα结构域之间会存在严重的空间位阻,因此二聚体的FcεRI将会解离成两个单体并分别与IgE抗体结合。至此,“FcεRI受体如何被IgE分子激活”的问题已经得到了完满的答案。不过,生物化学实验是在体外条件下进行的,在体内,是否也会发生类似的过程?为什么IgE抗体介导的FcεRI受体要从二聚体转变为单体?生物学意义何在?要回答这些关键的免疫学问题,显然仅靠生物化学手段还远远不够。这意味着,团队需要跨出自己的舒适区,进入新的领域来回答这些问题。在缺乏外部功能实验室协助的情况下,团队成员通过查阅资料,自学了免疫细胞培养、稳转细胞系构建、流式细胞术、荧光共振能量转移、转录组学分析、实时定量PCR及肥大细胞脱颗粒实验等技术。经过半年多的学习和技术积累,团队成员首先运用荧光共振能量转移(FRET)技术,在细胞膜水平验证了IgE抗体介导的FcεRI受体从二聚体转变为单体的过程。当FcεRI受体未结合IgE抗体时,它以二聚体形式存在,ITAM基序堆积在一起,阻碍下游信号激酶的激活。与IgE抗体结合后,受体转变为单体,暴露出ITAM基序,激活了下游信号通路,上调Egr1/3和Ccl2基因的表达,调控肥大细胞的生存、分化和迁移(图7)。对FcεRI的生化、细胞和结构方面的研究揭示了IgE介导的肥大细胞或嗜碱性粒细胞激活的分子机制,这些发现为过敏性疾病的治疗提供了新的线索。早在2000年左右,IgE抗体与FcεRI胞外区的晶体结构已被报道。在此基础之上,诺华公司设计并开发了一种名为奥马珠单抗的单克隆抗体,能够阻断IgE与FcεRI的相互作用。该药物于2003年被美国FDA批准,用于治疗中度至重度的持续性哮喘。如今,经过二十多年的研究,完整的FcεRI结构及IgE抗体介导的FcεRI激活机制首次被揭示。FcεRI二聚体结构的发现,为未来设计研发能够稳定FcεRI失活二聚体状态的抗体或类抗体药物提供了新思路,开创了一种全新的抗过敏药物设计方向。清华大学已毕业博士生、西湖大学访问学生陈梦莹为本研究的第一作者,独立完成了所有实验。深圳医学科学院特聘研究员宿强和西湖大学施一公教授为该文章的通讯作者。




![]()