冷冻电子显微镜(cryogenic electron microscopy, cryo-EM)是确定生物大分子近原子分辨率结构时广泛使用的技术。在制备成像样品时,需将纯化的大分子在薄薄的水膜内进行玻璃化;接着,利用配备直接电子相机的透射电子显微镜,我们就可以记录单个大分子颗粒的二维投影图像。由于每个颗粒在冰层中相对于电子束的方向不同,就会产生不同取向的投影。因此,精确确定每个二维颗粒投影的方向角,就成为生物大分子三维重建的主要目标。理想状态下,颗粒取向应均匀 ;然而,实际操作中很少观察到均匀的取向分布——这是由样本玻璃化的方式决定的。水膜边界处的两个界面会吸引大分子物体,并使它们倾向于附着在其中一个或两个界面上,形成“优势取向”。“优势取向”会导致颗粒对齐时发生错误,产生密度图畸变,严重影响了冷冻电镜密度图的获取和分析。
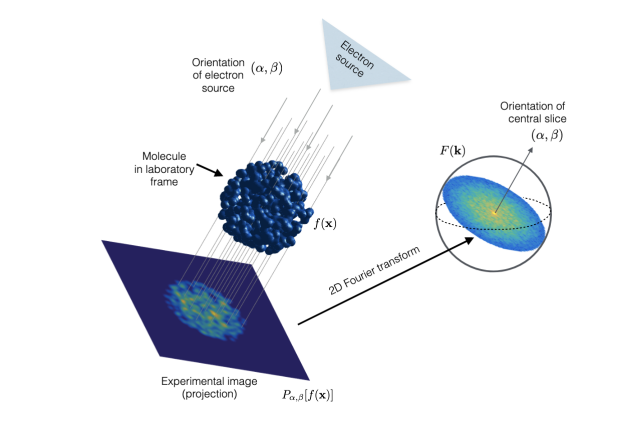
图注:冷冻电镜技术基于电子束
所成投影像恢复生物大分子密度图
北京时间2025年5月16日,胡名旭特聘研究员、包承龙副教授在《自然·通讯》(Nature Communications)杂志上共同发表了题为“CryoPROS: Correcting misalignment caused by preferred orientation using AI-generated auxiliary particles”的研究论文。

原文链接:https://www.nature.com/articles/s41467-025-59797-w
研究者首先发现在很多优势取向的情况下,损害重构密度图的原因是优势取向所诱导产生的颗粒对齐错误。
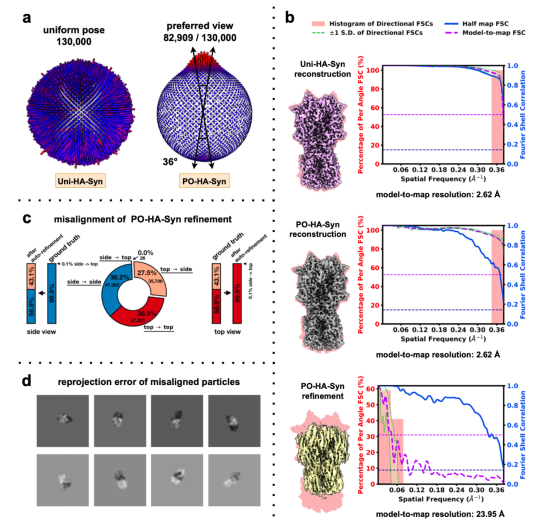
图注:在很多优势取向的情况下,损害重构密度图的
原因是优势取向所诱导产生的颗粒对齐错误
为了解决颗粒对齐错误,研究者们开发了CryoPROS算法。该算法利用生成式深度学习技术,训练人工智能生成辅助性颗粒。将实验采集的颗粒与人工智能生成的辅助性颗粒合并,能够大幅减弱颗粒取向分布的不均匀性,消除取向估计的偏差,从而精确确定每个二维颗粒投影的方向角,完成颗粒对齐。
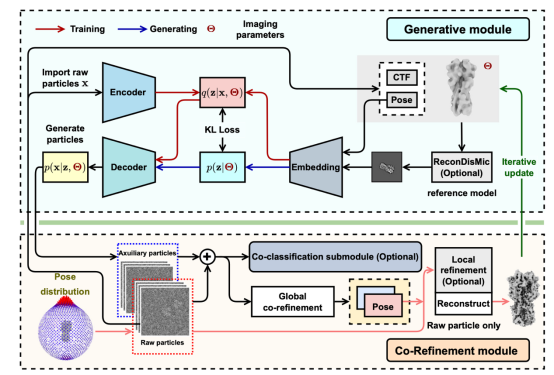
图注:CryoPROS算法的架构
利用CryoPROS软件,在冷冻电镜领域中广泛接受的优势取向基准数据集untilted HA-trimer (EMPIAR-10096) 可以达到3.49 Å的分辨率。长期以来,研究人员一直认为只有通过倾斜样品台采集数据(倾斜样品时采样效率低下、需要延长数倍采样时间才能完成相同数量颗粒的采集),并进行大量的三维分类、逐颗粒的CTF参数修正以及颗粒抛光(particle polishing),才能实现高分辨率重构。现在,CryoPROS软件可以省却这些繁琐的工作,而达到一样精确的分辨率。
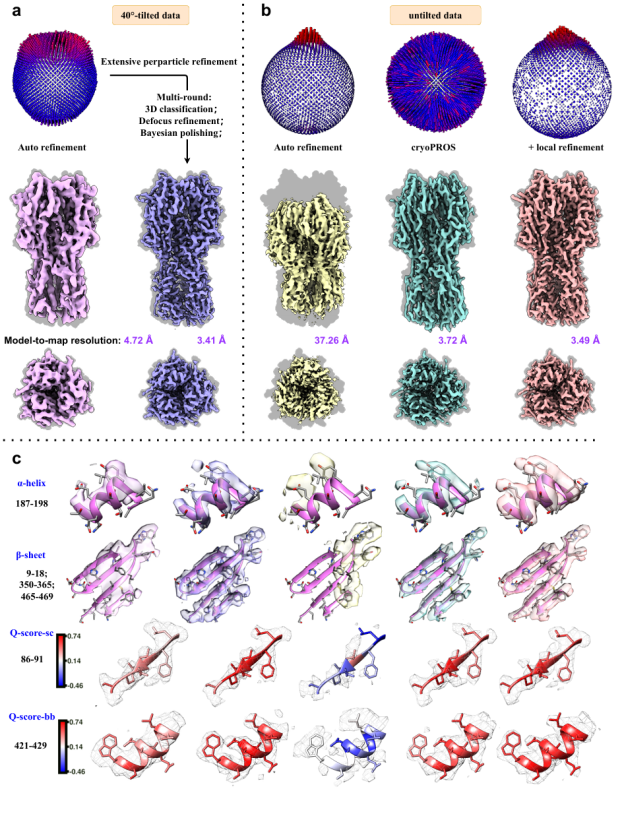
图注:CryoPROS在冷冻电镜领域中
广泛接受的优势取向基准数据集
untilted HA-trimer (EMPIAR-10096)
上达到3.49Å的分辨率

CryoPROS已在Github上发布
深圳医学科学院特聘研究员、北京市生物结构前沿中心(清华大学)研究员胡名旭,清华大学丘成桐数学中心副教授、北京雁栖湖应用数学研究院研究员、清华大学膜生物学重点实验室研究员包承龙,为本文的共同通讯作者。清华大学求真书院博士研究生张慧,清华大学丘成桐数学中心博士研究生郑棣瀚(已毕业),为本文的共同第一作者。本研究受到深圳医学科学院特聘研究员启动经费、北京市生物结构前沿中心(清华大学)、国家重点研发计划的资助。
冷冻电子显微镜(Cryo-EM)能够将样品快速冷冻,使生物大分子固定在一个近乎自然的瞬间,从而在接近原子级别的分辨率水平上提供更真实的、未被扭曲的生物分子图像。胡名旭课题组长期专注于开发冷冻电镜技术与方法的开发,在国际顶级学术期刊Nature Methods, Nature Communications, Communications Biology, Journal of Structural Biology, Nature, Nature Microbiology, PNAS 等发表论文数篇。

胡名旭课题组正在积极招聘结构生物学、生物化学、冷冻断层扫描(Cryo-ET)方向的副研究员、助理研究员以及博士后,详细招聘信息敬请期待。