疼痛,是人类最原始的感知之一,也是不易根治的医学难题。从古柯叶的麻醉奇效,到现代医学的精准干预,科学家从未停止对其本质的探寻。如今,一款靶向感觉神经元钠通道的新型镇痛药——Journavx(又名VX-548或Suzetrigine)获美国FDA批准上市,成为非阿片类慢性疼痛治疗的新曙光,为全球约三分之一饱受慢性疼痛困扰的人群,尤其是老年患者,提供了更安全、更高效的治疗新方案。

随着20世纪末分子生物学技术的进步,研究人员成功克隆出多个电压门控钠通道(VGSC)亚型,其中Nav1.7、Nav1.8和Nav1.9因其在感觉神经元中的特异表达而成为新兴的镇痛靶点。其中,Nav1.7因与遗传性疼痛疾病密切相关而备受关注,功能缺失突变可导致先天性无痛症,而功能获得突变则可引起剧痛综合征。但其在自主神经系统中的广泛分布也带来了较高的脱靶风险,限制了其作为治疗靶点的安全窗口。
相较而言,Nav1.8主要分布于外周感觉神经元,尤其在炎症性及机械性疼痛中发挥关键作用。其抑制剂被证实可显著减轻疼痛反应且副作用较低,成为更具潜力的治疗靶点。Nav1.9通道的药理研究相对滞后,选择性靶向策略仍处于初步探索阶段。
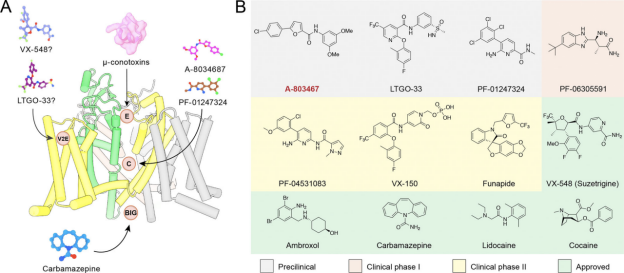
靶向Nav1.8的各类小分子药物及临床试验分子
在这过程中,Vertex公司开发的Nav1.8特异性抑制剂Journavx(又名VX-548或Suzetrigine)获FDA批准上市,标志着钠通道靶向镇痛药物迈入新纪元。研究显示,该药物通过选择性结合Nav1.8第二电压感受结构域(VSDII),以变构机制稳定其关闭状态,进而阻断疼痛信号的传导。Journavx不仅具有高度选择性和优异的口服成药性,还展现出持久镇痛效果和良好安全性,在临床试验中取得显著成果。
与此同时,诸如Latigo公司开发的LTG-01等新一代钠通道调节剂也在积极推进中。若能结合冷冻电镜(cryo-EM)等结构生物学技术进一步解析药物-通道相互作用机制,将有望推动更加精准、高效的第二代镇痛药物研发。
从偶然发现可卡因的麻醉特性,到以理性药物设计催生Journavx的成功上市,钠通道研究历经百年积累,终于迎来突破性成果。这不仅开启了疼痛治疗的新纪元,也生动诠释了基础研究如何驱动临床转化、改善患者生活的深远价值。