在自然界中,有一种“黑科技”藏在我们最意想不到的地方——蜘蛛毒液。这些曾被视为“致命武器”的神经毒素,正在成为精准调控神经信号的分子工具,助力开发治疗癫痫、慢性疼痛等神经系统疾病的创新药物。
北京时间2025年7月4日,深圳医学科学院颜宁/黄健团队在Cell Research(《细胞研究》)期刊在线发表了题为Phrixotoxin-3 binds to three distinct antagonistic sites on human Nav1.6的研究论文,首次揭示蜘蛛毒素Phrixotoxin-3(PaurTx3)通过三位点协同调控人源电压门控钠通道Nav1.6,为多肽类药物的设计提供了新思路。
电压门控钠通道(Nav)是神经系统中的重要“电闸”,它们能迅速响应膜电位变化,调控神经冲动的产生与传导。其中,Nav1.6亚型广泛分布于中枢神经系统,是调控神经放电的“主力通道”。Nav1.6的功能紊乱与癫痫等神经疾病密切相关。然而,Nav1.6虽然功能强大,但靶向它的药物极少。因此,开发其精准、特异性强的新型分子一直是神经药理领域的一大挑战。
PaurTx3是一种来自狼蛛的神经毒素。它本来的“职责”是麻痹猎物神经,让蜘蛛轻松捕食。研究团队借助冷冻电镜技术,首次完整解析了该毒素与Nav1.6结合的复合物结构。令人惊讶的是,PaurTx3不是靠单点调控,而是以其独特的“三位一体”结合模式精准靶向Nav1.6通道:
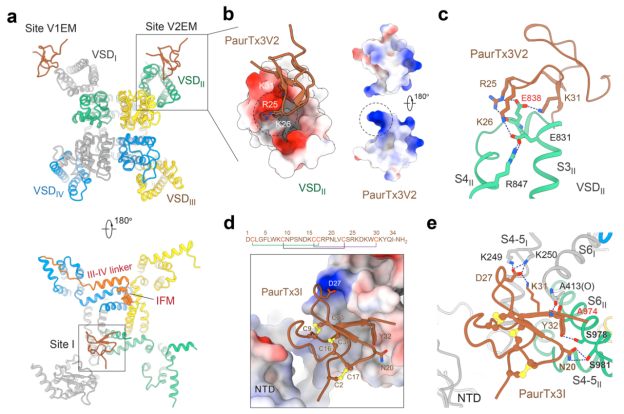
图 蜘蛛毒素Phrixotoxin-3通过三位点协同调控Nav1.6通道
钠通道的电压感受域(VSD)是感知电信号的关键元件。PaurTx3通过其正电性精氨酸残基与电压感受域独特的负电性口袋形成静电作用,直接“锁定”钠通道失活态抑制通道功能。其中关键位点E838的突变使得毒素的结合力显著下降,说明特定的电荷分布是毒素精准作用的关键。
PaurTx3能够精准结合通道胞内门控位点(位点I),从内部干预钠离子流动。尽管其跨膜转运途径有待进一步验证,这一“膜内突袭”方式打破传统药物仅能作用于通道外部的限制,提供了构建新一代“内外协同”药物的新视角。
此项研究不仅揭示了毒素如何多点协同调控Nav1.6的机制,还为结构导向的多肽类药物设计带来诸多启发:
优化电荷匹配:优化药物与靶蛋白的静电匹配,提升药物结合力;
构建跨膜调控:设计具备穿膜能力的药物片段,实现对细胞膜内关键调控位点的直接作用,拓宽靶点空间;
整合多靶策略:开发能同时作用于多个关键位点的多肽药物,提高治疗效果与特异性。
同时,多肽毒素作为精准靶向工具分子为新一代神经调控类药物的结构优化、机制验证和临床前开发提供了范例。从天然毒素到精准药物,科学家们正将“自然界的杀器”转化为“医学界的利器”。颜宁/黄健团队在解析Nav1.6结构、探索多肽毒素作用机制方面持续耕耘,有望开发靶向Nav1.6且具有全新作用模式的抗癫痫、镇痛及神经保护药物。
北京生物结构前沿研究中心研究员、深圳医学科学院创始院长、深圳湾实验室主任颜宁和深圳医学科学院特聘研究员黄健为本文的共同通讯作者。原普林斯顿大学分子生物学系博士后范潇和清华大学生命科学学院博士后陈娇凤为本文共同第一作者。深圳医学科学院副研究员黄晓爽、科研助理谢雨蓁与北京大学深圳研究生院博士生侯占峰参与了本研究。北京大学深圳研究生院、深圳湾实验室坪山生物医药研发转化中心资深研究员李子刚为本研究提供了重要帮助。本研究得到了国家自然科学基金、国际人类前沿科学计划组织(HFSP)长期学者基金与深圳医学科学院PI启动经费的支持。