
特聘研究员
结构药理学、药物化学
huangjian@smart.org.cn
在现代科学之前,人类只能像“神农尝百草”一样依据经验和传统知识来制药、用药。随着化学在18世纪崛起,药理学作为一门学科开始发展,研究药物如何在体内发挥作用,以及药物的作用机制。而后,伴随着生物大分子的发现,X射线晶体学的突破和结构生物学的诞生,科学家逐渐认识到药物与靶标蛋白之间的分子相互作用至关重要,结构药理学的基本概念开始成型。如今,结构药理学已经成为制药工业中的核心学科之一,在药物开发中扮演着至关重要的角色。通过解析生物大分子(如蛋白质、DNA、RNA)与药物或配体相互作用的三维结构,来理解其功能和机制,药物开发者可以设计出更高效力、更少副作用的靶向药物。而精准医学的兴起更是进一步凸显了结构药理学的重要性。
黄健博士长期从事结构药理学研究,专注于重大疾病相关膜蛋白的工作机制及配体调控机制。课题组主要运用结构生物学、药物化学、分子和细胞生物学以及生物化学等多学科技术手段,结合结构与活性分析,设计并优化靶向疾病相关膜蛋白的小分子调节剂,以实现对目标蛋白的精准调控,推动药物创新,致力于为重大疾病提供新型有效的干预与防治手段。
课题组将继续深入研究不同物种神经系统中关键膜蛋白的生理功能,以及外源分子对这些蛋白的调控机制,重点聚焦转运蛋白和离子通道等。课题组还将基于结构信息进行选择性调节剂的理性设计,旨在实现对靶蛋白的精准调控,并为疾病的预防与治疗提供潜在方案:
1. 神经系统中的膜转运蛋白与离子通道负责调控神经递质的储存与释放以及生物电信号的发生与传导,这些过程与多种疾病的发生和发展密切相关,如疼痛、癫痫和抑郁症等;
2. 有害昆虫不仅威胁农业生产,同时作为疟疾、寨卡、黄热病等多种传染性疾病的主要传播媒介,也对公共健康构成严重威胁。有效的害虫控制不仅能减少经济损失,还能降低病原体传播和传染病暴发的凤险。在昆虫,尤其是有害昆虫中,离子通道是其生命活动的重要调节器,也是进行害虫控制和应对虫媒传染病的潜在靶点,其功能异常或蛋白突变则是导致当前杀虫剂耐药性的关键因素。
膜转运蛋白调控物质的跨膜运输,对维持细胞稳态、能量转换和信号转导具有重要作用,是重要的药物靶点。近年来,黄健博士专注于研究两类重要的膜转运蛋白——葡萄糖转运蛋白和电压门控离子通道,旨在揭示其配体调控机制,并基于结构进行药物理性设计,为相关疾病的干预与防治提供新思路:
1. 提出靶向恶性疟原虫源己糖转运蛋白PfHT1“正构+别构”双位点共抑制策略,推动“饿死疟原虫”的抗疟新方法
疟疾是当今世界公共卫生的突出问题,随着耐药性疟原虫株的出现,疟疾防治变得愈加困难。因此,寻找新型抗疟药物靶点,开发具有新机制的抗疟药物,成为解决耐药性问题的关键。阻断疟原虫对葡萄糖的摄取,“饿死疟原虫”,可作为潜在的抗疟策略。黄健博士与合作者提出了靶向PfHT1蛋白“正构+别构”双位点共抑制策略,设计出亲和力更高、选择性更强的PfHT1抑制剂,能有效地选择性杀伤疟原虫,为解决现有药物的耐药性问题提供了新的途径(Cell, 2020; PNAS, 2021)。
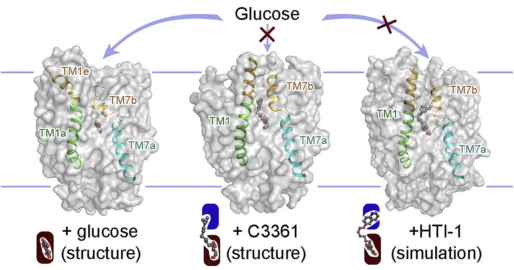
通过结构分析,兼顾底物结合的正构位点和抑制剂结合诱导产生的别构位点,设计出靶向PfHT1“正构+别构”双位点共抑制剂 (来源:Cell, 2020)
2. 系统性解析靶向电压门控钠通道的药物作用位点,揭示了双位点抑制的新机制和选择性靶向的新途径
电压门控钠通道(Nav)的异常活动与多种病理条件相关联,是许多抗癫痫药、止痛药和抗心律失常药物的直接作用靶点。黄健博士及合作者系统性研究药物分子及天然毒素对Nav通道的作用机制,揭示了实现配体调控的关键位点,为靶向离子通道的新药设计提供了重要模版,并发现了一种全新且普遍存在的双位点抑制模式,为靶向Nav通道的选择性调控提供了思路(Nature Communications, 2023a,2023b; PNAS, 2023a,2023b; Cell Research, 2024)。同时,黄健博士及合作者将目前所有已知的配体结合位点映射到Nav通道的三维结构上,并提出了一种单字母编码的位点命名系统。该系统增强了大家对Nav通道结构与功能关系的理解,并将助力靶向Nav通道的新药发现(Nature Reviews Molecular Cell Biology, 2024; Cell Chemical Biology, 2024)。
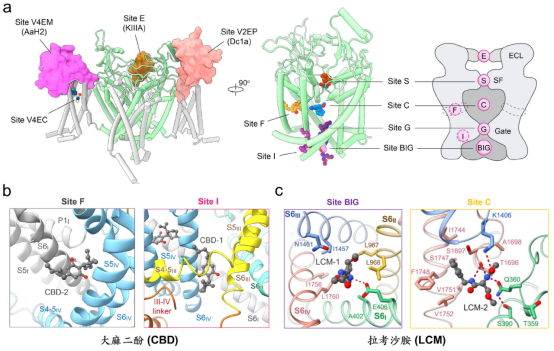
系统性解析靶向Nav通道的药物作用机制:a)单字母编码的药物作用位点命名系统:E表示胞外结构域,S表示选择性离子过滤器,C表示孔道中央腔,G表示胞内激活门,BIG表示胞内激活门下方结构域,F表示侧面窗孔,I表示失活模块IFM结合域,V表示电压感受域;b-c)药物分子的双位点抑制新模式:大麻二酚同时结合Site F和Site I,拉考沙胺同时结合Site C和Site BIG。(来源:Nature Reviews Molecular Cell Biology, 2024; Nature Communications, 2023a,2023b)
2024-至今 深圳医学科学院 特聘研究员
2021-2024 普林斯顿大学 分子生物学系 博士后
2016-2021 清华大学 化学系 博士
2012-2016 清华大学 化生基科班 学士
2021年 第十六届中国药学会科学技术奖一等奖(第三完成人)
2020年 Cell Press 2020中国年度论文奖
2020年 清华大学一等奖学金
2020年 清华大学结构生物学高精尖创新中心“创新博士生奖学金”
2020年 第二届化学生物学前沿研究生论坛最佳学生报告奖
2019年 第十一届全国化学生物学学术会议最佳学生报告奖
2016年 清华大学优良本科生
2014、2015年 中国教育部国家奖学金
2014年 “HACH”第九届全国环境友好科技竞赛三等奖
2014年 第七届全国大学生节能减排大赛二等奖
2013年 第三十届全国大学生物理竞赛二等奖
2011年 第二十五届全国高中化学奥林匹克竞赛一等奖
2010年 全国高中数学联赛二等奖
(#代表共同第一作者; *代表共同通讯作者)
1. Huang, J.; *Pan, X.; *Yan, N. “Structural biology and molecular pharmacology of voltage-gated ion channels”, Nat Rev Mol Cell Biol. 2024, doi: 10.1038/s41580-024-00763-7.
2. Jiang, X.#; Yuan, Y.#; Huang, J.#; Zhang, S.#; Luo, S.; Wang, N.; Pu, D.; Zhao, N.; Tang, Q.; Hirata, K.; Yang, X.; Jiao, Y.; Sakata-Kato, T.; Wu, J.W.; Yan, C.; Kato, N.; *Yin, H.; *Yan, N. “Structural Basis for Blocking Sugar Uptake into the Malaria Parasite Plasmodium falciparum”, Cell 2020, 183(1): 258-268.
3. Huang, J.#; *Fan, X.#; Jin, X.#; Lyu, C.; Guo, Q.; Liu, T.; Chen, J.; Davakan, A.; Lory, P.; *Yan, N. “Structural basis for human Cav3.2 inhibition by selective antagonists”, Cell Res. 2024, 34(6): 440-450.
4. Huang, J.#; Yuan, Y.#; Zhao, N.#; Pu, D.; Tang, Q.; Zhang, S.; Luo, S.; Yang, X.; Wang, N.; Xiao, Y.; Zhang, T.; Liu, Z.; Sakata-Kato, T.; *Jiang, X.; *Kato, N.; *Yan, N.; *Yin, H. “Orthosteric-allosteric dual inhibitors of PfHT1 as selective anti-malarial agents”, Proc Natl Acad Sci U S A. 2021, 118(3): e2017749118.
5. Huang, J.#; Fan, X.#; Jin, X.; Jo, S.; Zhang H. B.; Fujita, A.; *Bean P. B.; *Yan, N. “Cannabidiol inhibits Nav channels through two distinct binding sites”, Nat Commun. 2023, 14(1): 3613.
6. Huang, J.#; *Fan, X.#; Jin, X.; Teng, L.; *Yan, N. “Dual-pocket inhibition of Nav channels by the antiepileptic drug lamotrigine”, Proc Natl Acad Sci U S A. 2023, 120(41): e2309773120.
7. Wu, Q.#; *Huang, J.#; *Fan, X.#; Wang, K.#; Jin, X.#; Huang, G.; Li, J.; *Pan, X.; *Yan, N. “Structural mapping of Nav1.7 antagonists”, Nat Commun. 2023, 14(1): 3224.
8. *Fan, X.#; Huang, J.#; Jin, X.; *Yan, N. “Cryo-EM structure of human voltage-gated sodium channel Nav1.6”, Proc Natl Acad Sci U S A. 2023, 120(5): e2220578120.
9. *Jin, X.#; *Huang, J.#; Wang, H.#; Wang, K.; *Yan, N. “A versatile residue numbering scheme for Nav and Cav channels”, Cell Chem Biol. 2024, 31(8): 1394-1404.