北京时间2025年12月17日,深圳医学科学院黄健与范潇团队在浪淘沙预印本平台发布了标题为“Structural basis for the assembly and modulation of human M-channels”(人源M通道组装和调控的结构基础)的最新研究进展(图1)。该研究获得了人源M通道的高分辨率冷冻电镜结构,系统揭示了其异源组装方式、电压感应机制、药物识别模式以及一种依赖PIP2的分步门控新机制。
同期,另外两篇关于“M通道”的研究论文也在浪淘沙预印本平台上发布:西湖大学申怀宗与华东师范大学阳怀宇团队联合发布了题为 “Structural basis for heteromeric assembly and subthreshold activation of human M-channel” 的最新研究成果;南昌大学张进团队和澳门科技大学侯盼盼团队联合发布了题为“Structural basis of the neuronal M-current by an asymmetric KCNQ2/3 channel assembly”的最新研究成果。三项独立工作相互补充、彼此印证,共同拓展了对M通道的生物学认知。

图1. 成果发布在浪淘沙预印本平台(Langtaosha.org)
电压门控钾通道(Kv)是细胞膜上的一类重要“电控阀门”,在神经元、心肌细胞等细胞放电后,负责帮助膜电位迅速恢复到“平静”状态。正是这些通道参与的精细调控,决定了神经信号的准确传导与心脏搏动的节律。一旦该类通道的功能异常,就可能引发癫痫、心律失常及神经病理性疼痛等多种疾病[1]。除同源复合物外,许多Kv通道还可以形成异源复合体,实现对电压依赖性、门控行为、药物敏感性及疾病突变易感性的精细调控[2]。
在中枢神经系统中,KCNQ(又称Kv7)家族通道起着“稳压器”的作用,防止神经元过度兴奋或无序放电。其中,主要由KCNQ2/KCNQ3两种亚基共同组装形成的M通道,是防止神经过度兴奋的“分子刹车”。临床研究表明,只要其中任一亚基发生功能缺失突变,就可能诱发癫痫,因此M通道也是重要的抗癫痫药物靶点。
然而,一个长期存在的关键问题是:几乎所有已知的KCNQ通道结构研究,都是基于同源复合物。那么,发挥生理功能的异源M通道究竟如何组装?不同亚基如何实现分工协作?这些问题一直缺乏直接的结构证据,限制了领域内对其工作机制和药物调控模式的深入理解。
黄健与范潇团队通过共表达KCNQ2与KCNQ3蛋白,成功重构了具有功能的异源M通道,并通过全细胞膜片钳技术确认其具备典型的高电流传导特性。随后,借助冷冻电镜技术,团队解析了异源组装的通道结构:以3个KCNQ2与1个KCNQ3的组装比例为主,同时也存在少量2:2的组装形式;在2:2组装中,相同亚基呈现对角分布,显示出高度有序的装配方式(图2)。
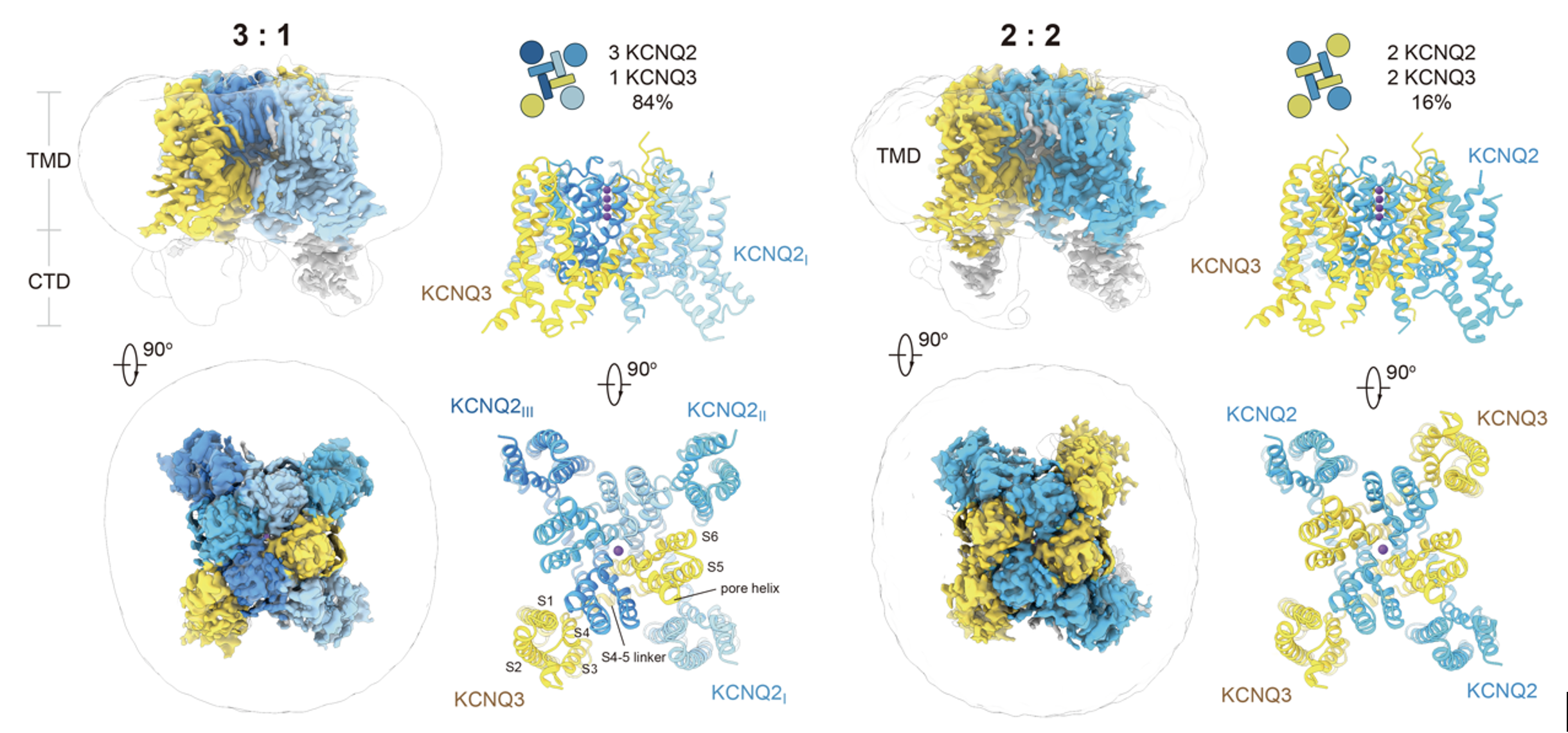
图2. M通道的异源组装方式
进一步分析发现,与KCNQ2相比,KCNQ3的电压感受域(VSD)表现出更易被“激活”的构象特征。功能实验进一步证明:当M通道的VSD被完全替换成KCNQ3的类型,通道就会在更低的电压条件下激活,直接证明了KCNQ3是驱动M通道低阈值激活的核心元件(图3)。
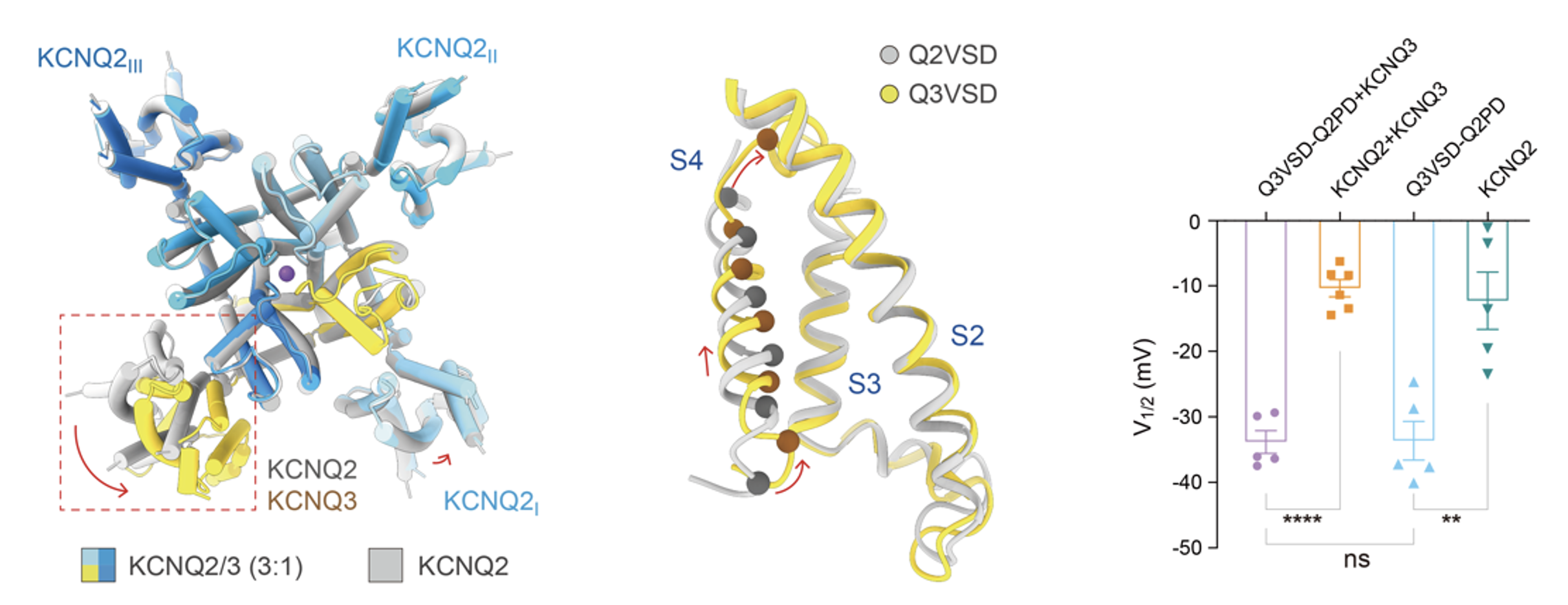
图3. KCNQ3降低了M-通道电压敏感性
在药物机制方面,研究团队还解释了两类代表性M通道调节剂的作用原理。其中ICA-110381分子选择性作用于KCNQ2的电压感受域,这一特性为不同亚基组合形式提供了有力佐证(图4)。
另一种备受关注、已进入临床III期试验的化合物XEN1101,则结合在通道孔道结构域(PD)侧面的一个保守“窗口”位点,并与PIP2协同作用,以分步激活的模式调控通道的逐步开放(图5)。
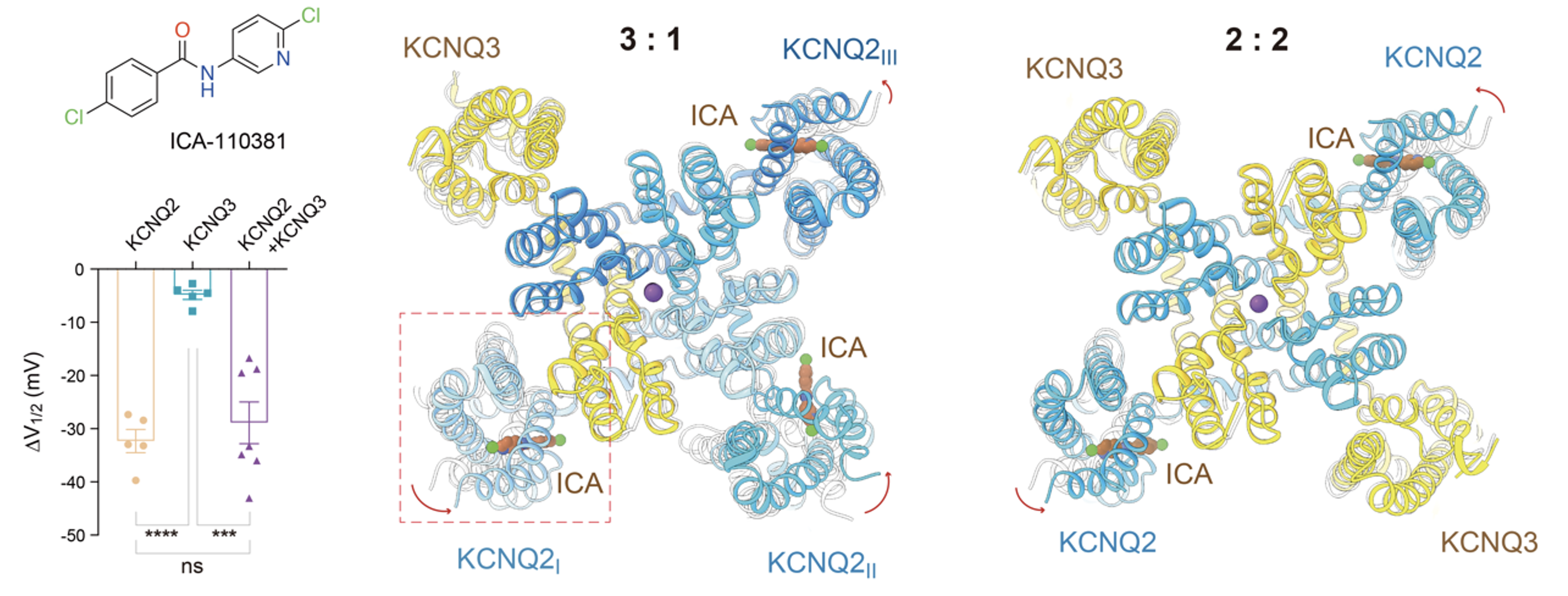
图4. ICA-110381选择性靶向KCNQ2亚基的电压感受域
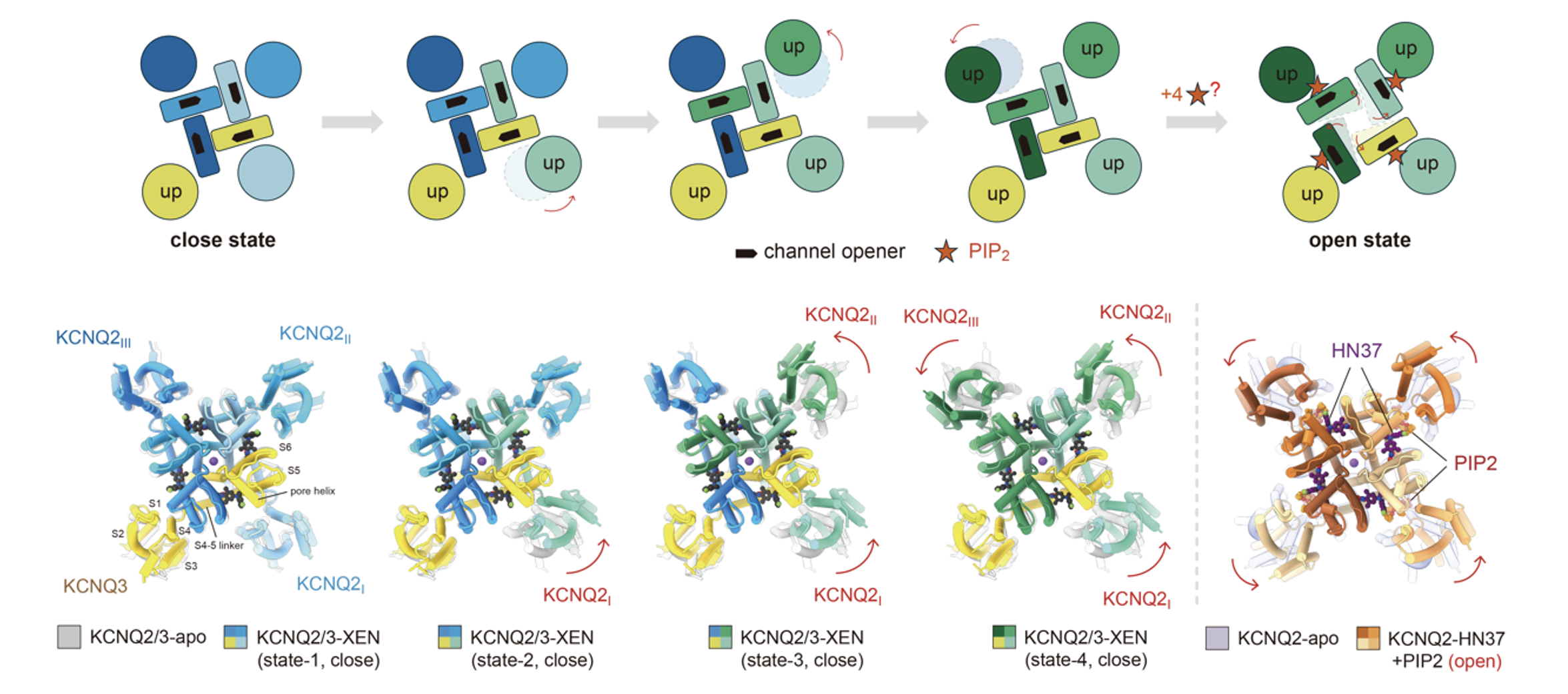
图5. XEN1101与PIP2协同的异源M通道分步激活模式
这项研究不仅填补了异源组装M通道结构生物学研究的关键空白,更重要的是,该研究揭示的亚基特异性药物结合位点与异源通道分步激活模式,为开发下一代高选择性、高活性且低副作用的抗癫痫药物提供了精确的结构模板,对发育性癫痫脑病等神经系统疾病的治疗具有重要意义。
深圳医学科学院特聘研究员黄健、范潇为本文的共同通讯作者。深圳医学科学院-西湖大学联培博士生陆方舟与深圳医学科学院副研究员黄晓爽为本文的共同第一作者。深圳医学科学院电生理平台工程师蔡冠星、黄健课题组研究助理谢雨蓁为研究工作做出重要贡献。该研究得到深圳医学科学院生物结构解析平台与生医药数据中心的大力支持,并获得深圳医学科学院及国家自然科学基金的资助。
浪淘沙预印本平台是由深圳医学科学院牵头,联合深圳湾实验室、清华大学、西湖大学、复旦大学等多家单位共建的学术预印本平台(Langtaosha.org),并得到了生命科学开放联盟(openlifesci-alliance.org)的大力支持。其核心使命是为全球生命科学领域的科研人员提供成果快速共享与交流的平台。
三篇研究在浪淘沙预印本平台的同期发布,形成了高度互补、彼此印证的系统性证据链:从通道组装原则、能量景观重塑,到小分子调控与疾病相关突变的结构解释,全面重塑了人们对M通道的理解。研究成果通过预印本平台的快速发布与共享,深刻体现了开放科学平台的核心价值:它不仅缩短了成果传播与交流的周期,使同一领域研究者能及时跟进、交叉验证,有效避免了重复研究和资源浪费,更通过“背靠背”研究的互鉴与互补,系统解决了M通道组装机制、门控逻辑等长期争议的关键科学问题。最终,这些协同突破为癫痫、自闭症等神经兴奋性疾病的精准药物设计提供了原子分辨率的结构蓝图,有望推动下一代靶向疗法的开发。这一案例生动证明,预印本平台在加速科学发现、促进跨团队协作、降低创新成本中的重要作用,也为未来基础研究与临床转化的高效衔接提供了可借鉴的开放科学范式。
原文链接:https://langtaosha.org.cn/index.php/lts/en/preprint/view/59
参考文献:
1. Wulff, H., Castle, N.A. & Pardo, L.A. Voltage-gated potassium channels as therapeutic targets. Nat Rev Drug Discov 8, 982-1001 (2009).
2. Huang, J., Pan, X. & Yan, N. Structural biology and molecular pharmacology of voltage-gated ion channels. Nat Rev Mol Cell Biol 25, 904-925 (2024).