冷冻电子断层成像(Cryo-electron tomography,Cryo-ET)通过在低温下对生物样品进行多角度采集,实现从天然状态下对组织与细胞内生物大分子结构的亚纳米到近原子分辨率三维成像,能够将分子、细胞与组织层面的结构信息有机整合,是原位结构解析与细胞生物学新现象发现的重要工具。尽管当前 Cryo-ET 在单细胞层面的应用已较为成熟,但在更接近天然生态的多细胞组织样品上仍面临诸多技术瓶颈。其中,冷冻聚焦离子束减薄(Cryo-focused ion beam,Cryo-FIB)是制备适用于冷冻电镜数据采集的组织薄片(lamellae)的关键环节,也是原位结构研究的限速步骤;然而,现有方法在操作难度、lamellae 稳定性和制备效率等方面仍有待提升。
近日,深圳医学科学院李美静团队在Biophysics Reports期刊背靠背发表两篇论文,题为“Step-by-step procedure for an optimized serial lift-out cryo-focused ion beam milling technique in tissue analysis”和“Structural plasticity of mouse intestinal microvilli revealed by tissue-level cryo-ET”。
团队提出并系统化了一套针对多细胞组织样品的优化 Serial-lift-out cryo-FIB 工作流程,显著提升了 lamellae 的稳定性、制备效率与方法重复性,同时降低了对操作人员经验的依赖。该优化方案的核心包括六面附着与可调狭缝间距设计,能够高效提取不同尺寸的组织块并将其精确附着到预先铣削的电镜载网上;整个流程还整合了高压冷冻与冷冻光电关联(Cryo-CLEM)等步骤,从样品冷冻固定到最终薄片制备形成一条完整、通用的组织级原位结构研究通路。该方法适用于各种生物组织中对特定细胞、亚细胞结构或生物大分子的原位结构研究。
基于上述优化的 Serial-lift-out cryo-FIB 与 Cryo-ET 流程,李美静团队获取了大量小鼠肠道组织的超微结构数据。在这些数据中,研究人员捕获到多种分枝状微绒毛(microvilli)结构——分枝微绒毛的比例明显高于线虫肠道中观察到的类型。该发现提示哺乳动物刷状缘结构存在此前未被充分认识的高度可塑性,并为“微绒毛更新过程中可能存在类分裂机制”的观点提供了直接的结构学证据。

原文链接:https://www.biophysics-reports.org/article/doi/10.52601/bpr.2025.250039

原文链接:https://www.biophysics-reports.org/article/doi/10.52601/bpr.2025.250038
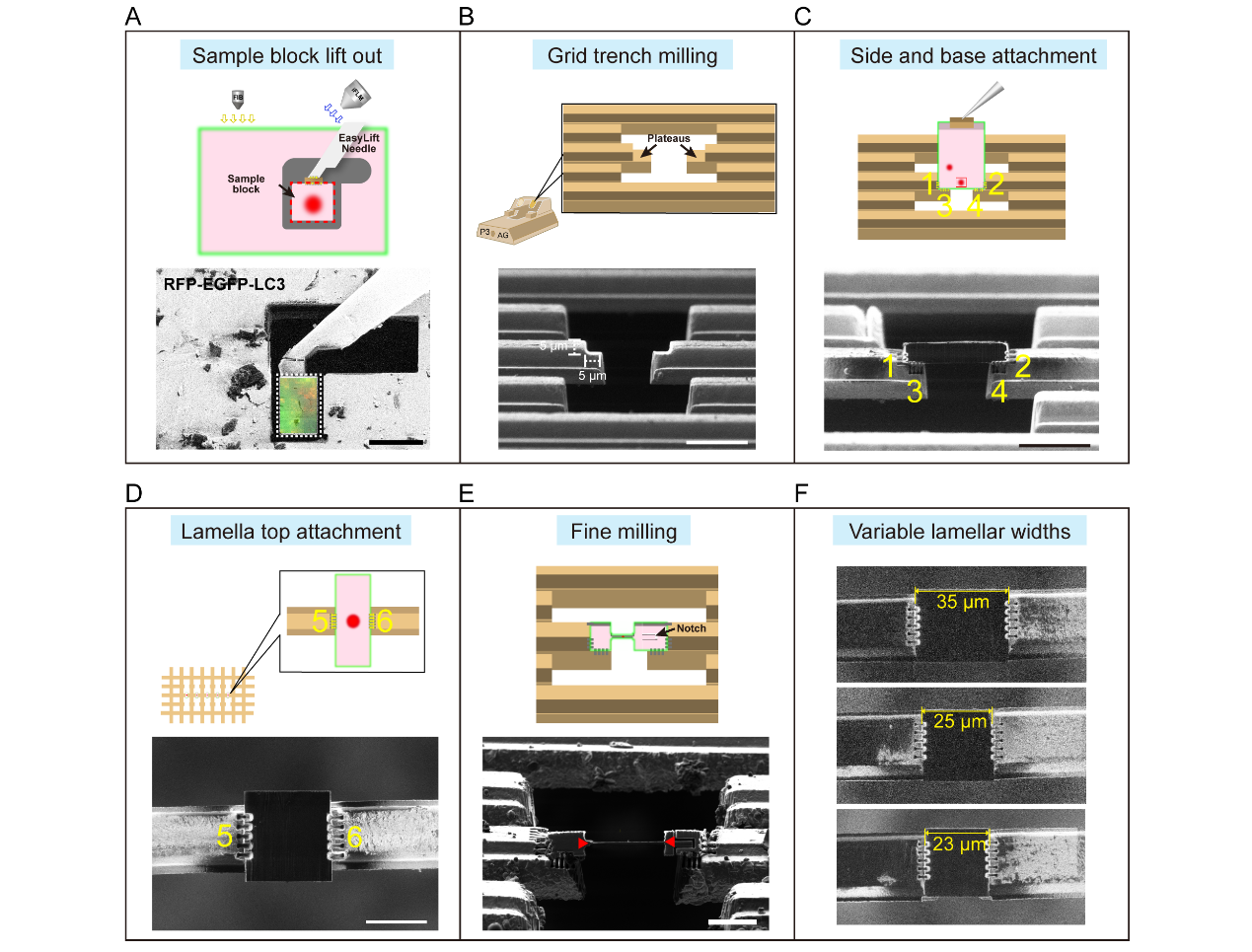
图1. 优化的Serial lift-out cryo-FIB主要工作流程
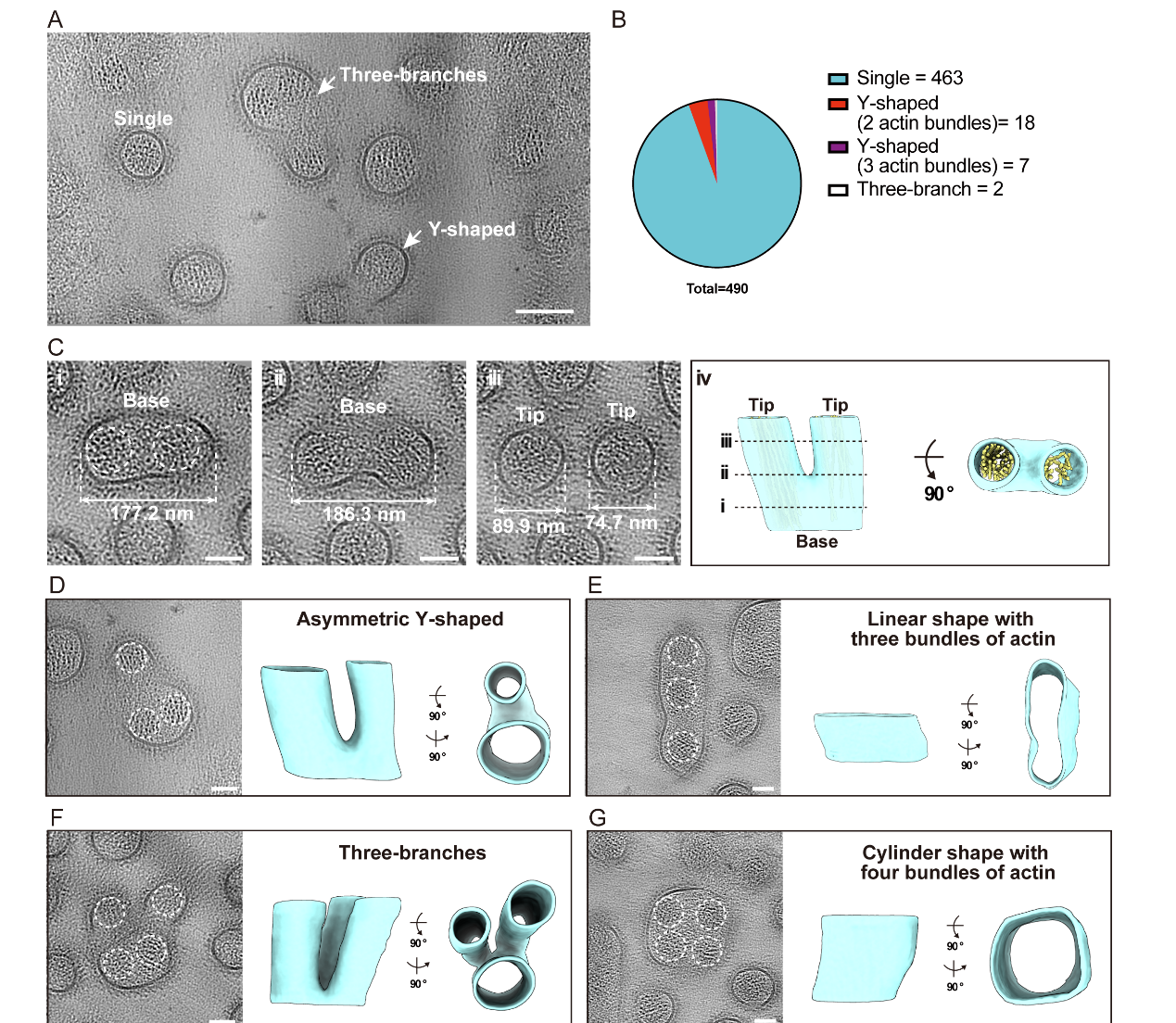
图2. 小鼠肠道内多种分枝状微绒毛原位结构
深圳医学科学院生物构造与互作研究所李美静研究员为两篇论文通讯作者,刘佳明副研究员和博士生唐晓渝分别为两篇论文的第一作者,博士生黄欢欢、郑敬涛、于子航,与博士后王鹏为研究工作做出重要贡献。深圳医学科学院生物结构解析平台、高性能计算平台提供了电镜数据采集和计算支撑。研究受到深圳医学科学院、国家重点研发计划的资助。