电压门控钠离子通道(Nav)是介导生物电信号产生与传导的核心跨膜蛋白,广泛参与神经递质释放、肌肉收缩、激素分泌和外界刺激感知等关键生理过程。它们如同细胞膜上的“分子闸门”;当膜电位发生变化时,通道的电压传感结构域(voltage-sensing domain, VSD)会感知电信号,并在电场力的驱动下发生构象变化,从而打开闸门,允许钠离子内流,引发并传播电信号。尤为关键的是,该通道在开放后仅维持数毫秒便会迅速关闭,这一“快速失活(fast inactivation)”特性被认为是确保动作电位的“全或无”及单向传导的分子基础,为神经冲动和肌肉收缩等过程提供了精确的时空调控。然而,正因其开放状态转瞬即逝,如何“捕捉”并解析这一关键状态的高分辨率精细结构,一直是该领域长期面临的核心难题和技术瓶颈。[1-3]
北京时间2025年11月18日,深圳医学科学院颜宁/黄健/范潇团队联合北京大学宋晨团队在预印本网站浪淘沙发布最新研究成果,论文标题为“Open-state structure of veratridine-activated human Nav1.7 reveals the molecular choreography of fast inactivation”(基于藜芦定激活的人源Nav1.7通道开放状态结构揭示钠通道快速失活分子机制)。
该研究首次解析了人源电压门控钠离子通道Nav1.7在开放状态下的精细三维结构,为揭示其快速失活门控机制提供了缺失的关键证据。为解决开放态难以稳定和捕捉的难题,研究团队巧妙利用藜芦定(veratridine)对钠通道门控的调控特性,稳定了一小部分处于开放状态的通道分子,并借助冷冻电镜技术成功重构其高分辨率三维结构,得以一窥钠通道完整工作周期中最为核心的“开放”构象。

图1,浪淘沙预印本
在本研究中,研究团队成功捕获两种与藜芦定结合的Nav1.7复合物结构(图2)。其中一种构象中藜芦定嵌入IFM结合角区域(位点I),与其他常见失活态结构类似;而在另一种构象中,藜芦定贯穿中央空腔(位点C),该构象显示胞侧门控收缩处的孔径达8.2埃,超过水合钠离子的直径(图3)。分子动力学模拟显示,该构象所对应的通道完全通透,并在模拟中呈现与实验结果相近的电导值,代表处于激活开放态的功能性结构(图3)。通过对比开放态与失活态的精细结构差异,研究团队得以清晰描绘Nav1.7由开放向失活转变的构象变化路径,为理解其门控及快速失活的分子机制提供了直观的结构基础(图4)。
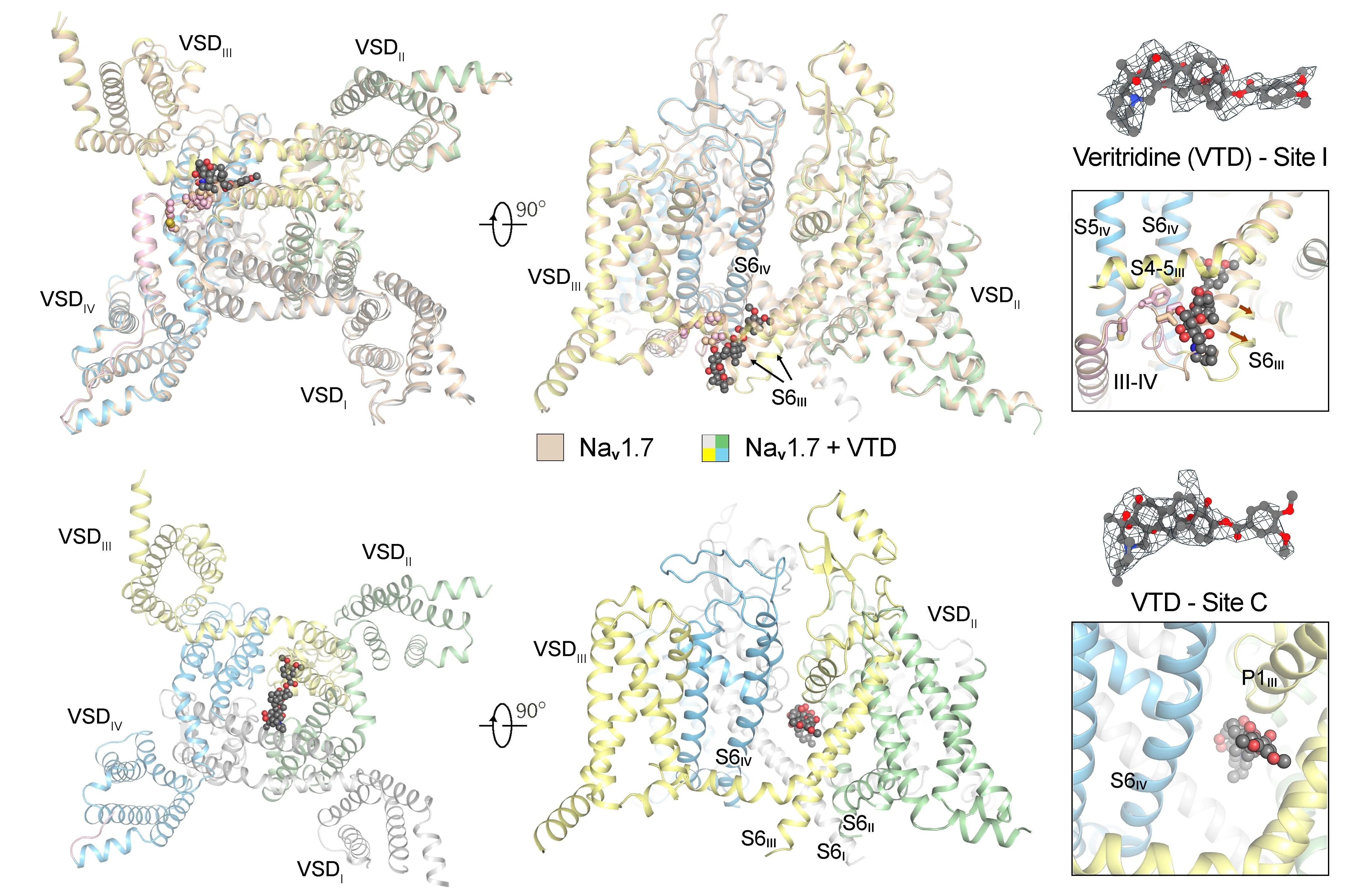
图2,藜芦定结合Nav1.7的两种模式
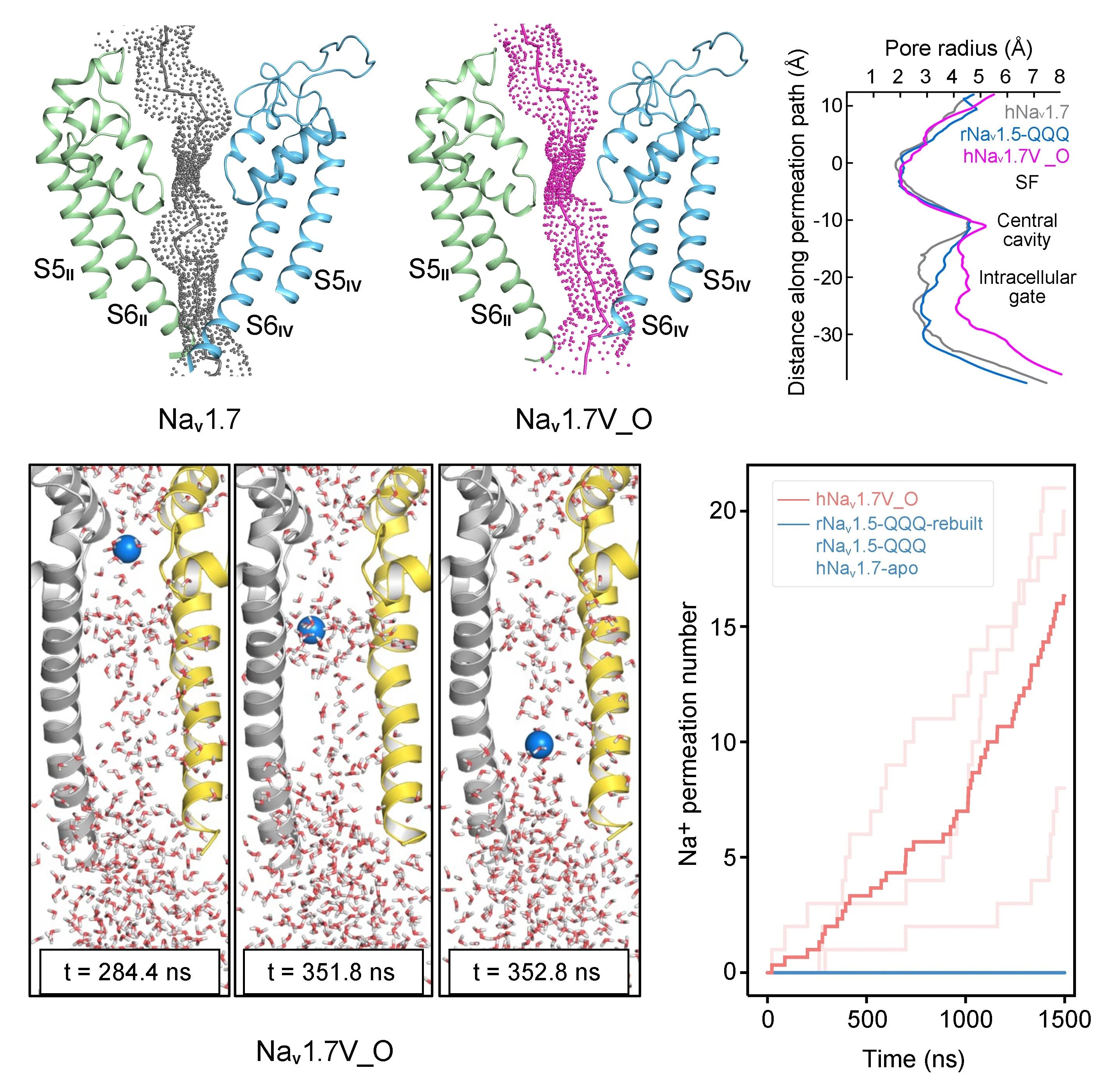
图3,开放状态的Nav1.7在分子动力学模拟中完全通透
电压门控钠通道功能异常与多种严重疾病密切相关,包括癫痫、心律失常、持续性疼痛以及先天性痛觉缺失等。目前,在人类九种钠通道蛋白中已鉴定出逾一千个与已知疾病相关的致病突变。另一方面,钠通道也是多类临床常用药物(如局部麻醉药、抗癫痫药和抗心律失常药)的直接作用靶点,这些药物往往通过选择性结合通道的特定状态(如开放态或失活态)发挥治疗作用。[4-7]
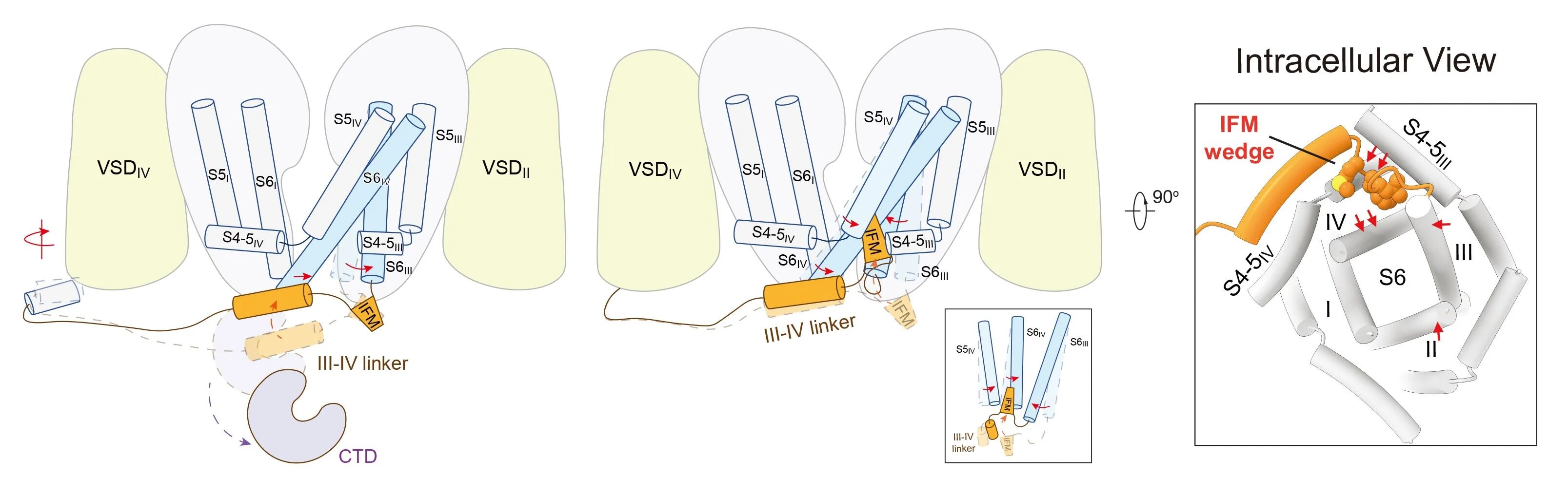
图4,钠通道快速失活的分子机制模型
因此,获取Nav1.7等钠通道开放状态的高分辨率结构,不仅有助于从原子层面系统阐明其门控工作原理和快速失活的本质,还为精确解释大量致病突变所引起的功能缺陷提供了坚实的结构依据。更为重要的是,这一开放态结构为设计和优化靶向特定功能状态、具有更高选择性与更低副作用的新一代钠通道调控药物,提供了前所未有的精确结构模板,对神经系统疾病、心血管疾病以及慢性疼痛等重大疾病的药物研发具有重要的理论和应用价值。
深圳医学科学院创始院长、深圳湾实验室主任颜宁、深圳医学科学院特聘研究员黄健、深圳医学科学院特聘研究员范潇、北京大学定量生物学中心宋晨研究员为本文的共同通讯作者。深圳医学科学院特聘研究员范潇、清华大学生命科学学院陈姣凤博士、北京大学定量生物学中心薛凌峰博士为本文的共同第一作者。清华大学生命科学学院王欢博士、吴童博士、副研究员靳雪芹及深圳医学科学院副研究员黄晓爽、博士生陆方舟为研究工作做出重要贡献。研究受到深圳医学科学院、国家自然科学基金、北京生物结构前沿研究中心资助。
参考文献:
[1] Hille, B. Ion channels of excitable membranes, 3rd edition. (2001)
[2] Hodgkin, A. L., & Huxley, A. F. (1945). Resting and action potentials in single nerve fibres. The Journal of Physiology, 104(2), 176.
[3] Huang, J., Pan, X., & Yan, N. (2024). Structural biology and molecular pharmacology of voltage-gated ion channels. Nature Reviews Molecular Cell Biology, 25(11), 904-925.
[4] Woolf, C. J., & Mannion, R. J. (1999). Neuropathic pain: aetiology, symptoms, mechanisms, and management. The Lancet, 353(9168), 1959-1964.
[5] Catterall, W. A. (2014). Sodium channels, inherited epilepsy, and antiepileptic drugs. Annual Review of Pharmacology and Toxicology, 54(1), 317-338.
[6] Huang, W., Liu, M., Yan, S. F., & Yan, N. (2017). Structure-based assessment of disease-related mutations in human voltage-gated sodium channels. Protein & Cell, 8(6), 401-438.
[7] Rubinstein, M., Patowary, A., Stanaway, I. B., McCord, E., Nesbitt, R. R., Archer, M., ... & Brkanac, Z. (2018). Association of rare missense variants in the second intracellular loop of NaV1. 7 sodium channels with familial autism. Molecular Psychiatry, 23(2), 231-239.