电压门控钠离子通道(Nav)是介导生物电信号的核心跨膜蛋白,广泛参与神经递质释放、肌肉收缩、激素分泌及外界刺激感知等关键生理过程。Nav功能异常可能导致癫痫、心律失常和持续性疼痛等疾病。作为细胞膜上的“分子闸门”,Nav通道通过电压传感结构域(VSD)感知膜电位变化,并在电场力的驱动下发生构象变化,从而打开闸门,允许钠离子内流,进而引发并传播电信号。通道在开放后仅维持数毫秒便会迅速关闭,这一“快速失活(fast inactivation)”机制被认为是确保动作电位的“全或无”特性及单向传导的分子基础,为神经冲动和肌肉收缩等过程提供了精确的时空调控。然而,开放状态转瞬即逝,使得其结构难以捕捉。
北京时间2026年01月25日,深圳医学科学院颜宁、黄健和范潇团队联合北京大学宋晨团队在Vita首期杂志上发表了题为“Open-state structure of veratridine-activated human Nav1.7 reveals the molecular choreography of fast inactivation”的文章。

文章通过冷冻电镜技术首次解析了人源电压门控钠离子通道Nav1.7在开放状态下的精细三维结构,成功捕获通道开放的关键 “分子瞬间”,为揭示钠通道快速失活的核心机制填补了关键空白。在本研究中,研究团队巧妙引入来源于百合花科植物的脂溶性神经毒素藜芦定(Veratridine)作为钠通道激动剂,成功捕获了两种Nav1.7与藜芦定结合的复合物结构。其中一种构象中,藜芦定嵌入IFM结合角区域(位点I),与之前报道的失活态结构类似;而在另一种构象中,藜芦定贯穿中央空腔(位点C),呈现出激活态构象。在这一构象中,胞侧门控收缩处的孔径达8.2埃,足以容纳7.2埃的水合Na+离子进行渗透。进一步分子动力学模拟结果表明,该构象所对应的通道完全通透,并且在模拟中呈现的电导值与实验结果高度一致,证实该功能性结构的确处于激活开放态。
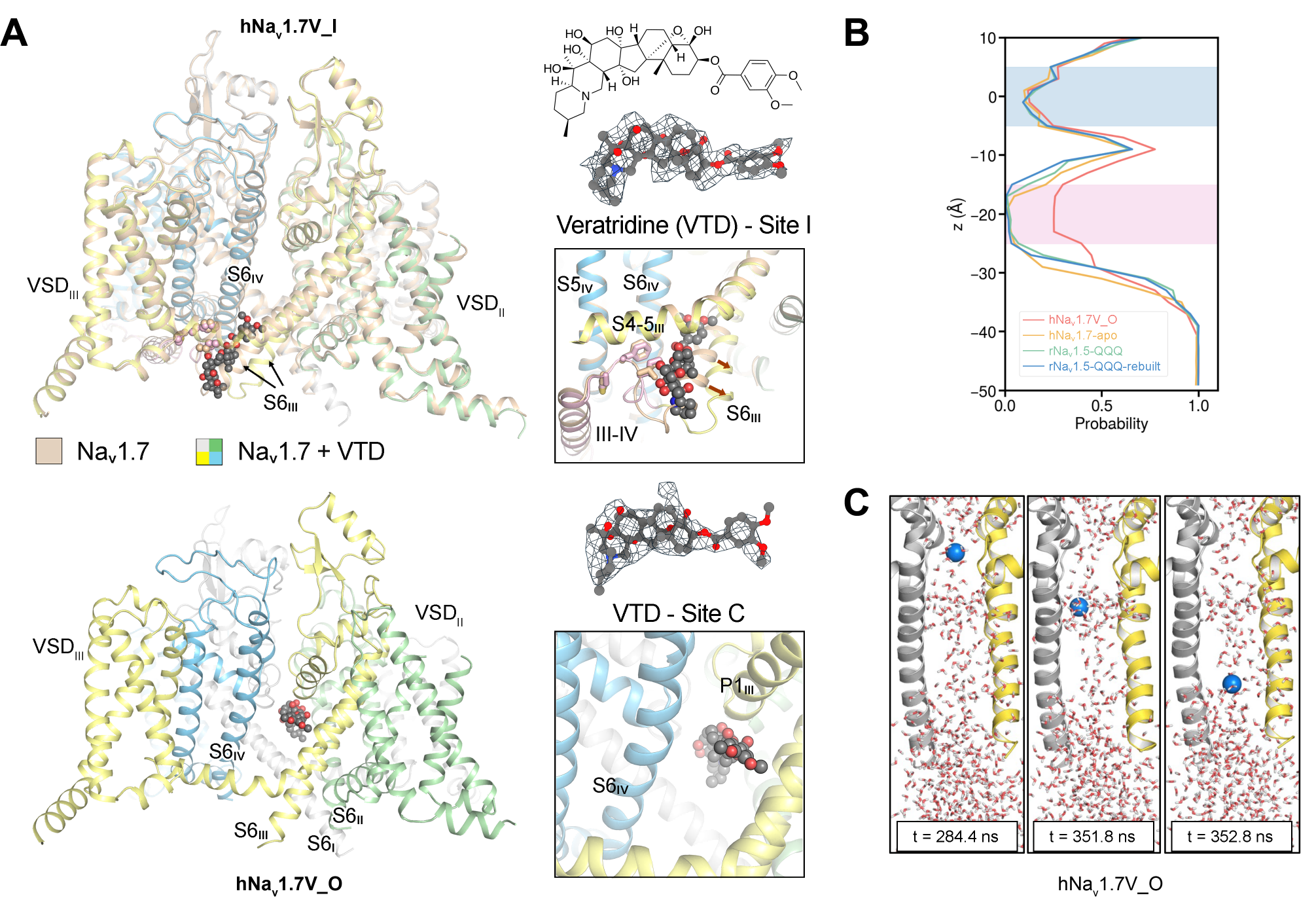
藜芦定与Nav1.7的两种结合模式及分子模拟实验结果
基于这一核心结构,研究团队结合已发表的钠通道失活态结构进行系统性对比,清晰勾勒出 Nav1.7从开放到失活的构象变化轨迹,为从原子层面解析钠通道门控机制与快速失活过程提供了直观的结构视角。
钠通道是局部麻醉药、抗癫痫药、镇痛药等临床药物的重要靶点。Nav1.7开放状态的高分辨率结构解析将有助于深入理解其门控机制和快速失活过程,并为解释致病突变提供结构依据。更重要的是,这一结构为设计靶向特定功能状态、具有高选择性和低副作用的新一代钠通道药物提供了精确模板,对神经系统疾病、心血管疾病及慢性疼痛等重大疾病的药物研发具有重要应用价值。
值得关注的是,该研究于2025年11月18日率先发表于“浪淘沙预印本平台”,成为该平台上线后的首篇论文,迄今累计浏览量已近8000人次,全文下载超2000次。随后,论文经严格同行评议,正式发表于由生命科学开放联盟联合建设的生命科学与生物医学领域高水平国际期刊Vita,并成为该期刊首期发表的重要成果之一。
这一从预印本平台快速公开到顶级期刊正式发表的完整传播链条,生动体现了Vita期刊“零OA费用、回归学术本源”的办刊理念,并通过浪淘沙平台实现了科研成果的即时开放共享,完美践行了“全网免费即时预览+严格同行评议+期刊发表”的创新传播模式。该模式在兼顾传播效率与学术公信力的同时,有效提升了研究成果的可见度与影响力,充分展示了“自主平台+国际顶级期刊”协同构建开放学术生态的独特优势。

成果此前已发表于浪淘沙预印本平台
深圳医学科学院创始院长、深圳湾实验室主任颜宁、深圳医学科学院特聘研究员黄健、深圳医学科学院特聘研究员范潇、北京大学定量生物学中心宋晨研究员为本文的共同通讯作者。深圳医学科学院特聘研究员范潇、清华大学生命科学学院陈姣凤博士、北京大学定量生物学中心薛凌峰博士为本文的共同第一作者。清华大学生命科学学院王欢博士、吴童博士、副研究员靳雪芹及深圳医学科学院副研究员黄晓爽、博士生陆方舟为研究工作做出重要贡献。研究受到深圳医学科学院、国家自然科学基金、北京市自然科学基金及北京生物结构前沿研究中心资助。